Перспективы создания и использования государственных стандартных образцов для проведения анализа лекарственных препаратов на примере триазавирина
- Главная
- /
- Новости
- /
- Перспективы создания и использования государственных стандартных образцов для проведения анализа лекарственных препаратов на примере триазавирина
В последние десятилетия значительно повысился уровень технического развития фармацевтической отрасли, расширилась номенклатура лекарственных средств, изменились требования к их качеству и методам контроля. Это вывело требования к фармакопейному анализу на совершенно другой уровень и определило чёткую тенденцию к переходу на расширенное использование физических и физико-химических методов анализа. Обзор зарубежных фармакопейных статей позволяет сделать заключение, что для установления подлинности, анализа чистоты и количественного определения ведущие фармакопеи преимущественно используют именно эти методы. В соответствии с современными требованиями [1,2,3,4] в целях реализации данных методов контроля качества практически любого лекарственного средства используют стандартные образцы. Стандартные образцы необходимы для контроля качества лекарственных средств по таким важнейшим показателям качества, как «Идентификация», «Количественное определение», «Примеси».
С одной стороны, это и облегчает анализ, и делает его более достоверным, с другой стороны, возникает необходимость наличия и доступности стандартных образцов состава активных фармацевтических субстанций. Исторически государственные стандартные образцы появились в ХI фармакопее СССР, а до её выхода разрабатывались соответствующие фармакопейные статьи на стандартные образцы [5,6], при этом количество ГСО всегда существенно ограничивало применимость сравнительных методов анализа. Выход ХII фармакопеи России и, в особенности, Федерального закона № 61-ФЗ от 12.04.2010 г. «Об обращении лекарственных средств» ещё больше запутал ситуацию, так как в законе такое понятие, как стандартный образец, просто отсутствует и появляется вновь только в Федеральном законе № 429-ФЗ от 22.12.2014 г. «О внесении изменений в Федеральный закон «Об обращении лекарственных средств», где вводятся определения стандартного образца и фармакопейного стандартного образца, произведённого в соответствии с фармакопейной статьей [7,8].
Согласно Европейской фармакопее (ЕР) стандартные образцы используют для достижения надлежащего уровня контроля качества лекарственных средств [1,9]. Стандартные образцы применяют для контроля качества лекарственных средств, начиная от разработки лекарственных препаратов и вплоть до их использования потребителем. При разработке лекарственных средств уже на стадии валидации аналитических методик необходимо уделять серьёзное внимание использованию стандартных образцов.
Доступность стандартных образцов фактически во многом определяет уровень контроля качества лекарственных средств в стране. Идентификация в большинстве случаев может быть проведена методом тонкослойной хроматографии (ТСХ), а количественное определение – методом спектрофотометрии, и, таким образом, даже для государственных лабораторий контроля качества лекарственных средств 1 уровня по классификации ВОЗ (имеющих минимальное приборное оснащение) [10] потребность в официальных стандартных образцах достаточно велика.
Ещё один важнейший фактор обеспечения контроля качества лекарственных средств для потребителя – номенклатура официальных стандартных образцов. Политика американской фармакопеи (USP) состоит в том, что примерно для 80 % препаратов, находящихся на рынке, должны быть введены в действие фармакопейные монографии и, соответственно, иметься фармацевтические стандартные образцы, необходимые для контроля качества и субстанции, и препарата. Номенклатура фармацевтических стандартных образцов USP составляет около 2600 наименований. Номенклатура стандартных образцов Государственной фармакопеи Украины (ГФУ) на ноябрь 2015 г. – более 600 наименований, причём она достаточно интенсивно расширяется.
Для сравнения, в Российской Федерации в настоящий момент в фармацевтическом анализе используются стандартные образцы зарубежных фармакопей и практически нет отечественных. Вопрос о статусе (государственной регистрации или включении в Государственный реестр ЛС) фармакопейных стандартных образцов на лекарственные препараты отечественного производства с действующими веществами, не включёнными в иностранные фармакопеи (EP, BP, USP и др.), представляет собой пробел в существующем нормативном регулировании, а именно: отсутствует порядок утверждения нормативной документации на стандартные образцы и включения их в Государственный реестр лекарственных средств.
Также стоит отметить, что с 1 января 2014 г. в России осуществляется переход на производство лекарственных средств в соответствии со стандартами Надлежащей производственной практики (GMP), реализуемый в соответствии с положениями приказа Минпромторга России № 916 от 14.06.2013 г., утвердившим Правила организации производства и контроля качества лекарственных средств. Этот документ является аналогом европейских правил надлежащей производственной практики. Предполагается, что в недалёком будущем все отечественные фармацевтические компании будут производить лекарства в соответствии с международными стандартами качества. Система фармацевтических стандартных образцов, принятая в СССР [11], существенно отличалась от таковой в странах, где действуют правила GMP. Таким образом, внедрение европейских стандартов производства и контроля качества лекарственных средств потребует создания системы фармацевтических стандартных образцов, отвечающей требованиям GMP и практике передовых фармакопей мира.
В сложившейся ситуации представляется важным обсудить проблему разработки и введения в действие системы государственных стандартных образцов для использования в анализе существующих и вновь разрабатываемых активных фармацевтических субстанций и новых лекарственных средств.
Цель исследования: предложить порядок и процедуру разработки и государственной регистрации стандартных образцов состава субстанций на примере оригинального отечественного противовирусного лекарственного средства Триазавирин.
Материалы и методы исследования. Исследования проводились на базе технопарка «Новоуральский». Использовалась субстанция препарата Триазавирин ФС-000279 и готовая лекарственная форма капсулы Триазавирина 250 мг ЛП-002604. Для анализа и изготовления стандартного образца использовалась технологическая и приборная база ООО «Уральский центр биофармацевтических технологий».
Химическое название: метилтионитрооксодигидротриазолотриазинид натрия.
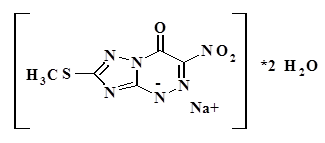
Эмпирическая формула С5Н7N6NаО5S.
По номенклатуре ИЮПАК: натрия 7-Метилтио-3-нитро-4-оксо-1,4-дигидро[1,2,4]триазоло[5,1-с] [1,2,4]триазин-1-ид дигидрат.
Обсуждение результатов. Одной из серьёзнейших проблем разработки стандартных образцов для субстанций лекарственных препаратов является необходимость получения стабильных при хранении образцов хотя бы достаточный на период времени обращения этих стандартов. Оптимальным может быть состав, идентичный составу субстанции, исключающий наличие посторонних примесей и принимаемый за 100 %. Такая проблема актуальна для субстанций, выпускаемых в форме кристаллогидратов или сольватов. При разработке стандартного образца субстанции триазавирина было необходимо изучить структуру и стабильность субстанции в различных условиях. Ещё при разработке технологии производства триазавирина было замечено, что безводный образец при попадании на воздух очень быстро набирает от одной до двух молекул воды в зависимости от влажности воздуха. При этом даже при кристаллизации из 70 % этанола триазавирин получался дигидратом, сольватных молекул этанола замечено не было. Для оценки прочности сольвата были проведены термогравиметрические исследования дигидрата триазавирина, которые показали, что первая молекула воды начинает отщепляться при температуре до 100°С, а полностью вода отщепляется при 150°С. Термогравиметрические кривые приведены на рис.1.
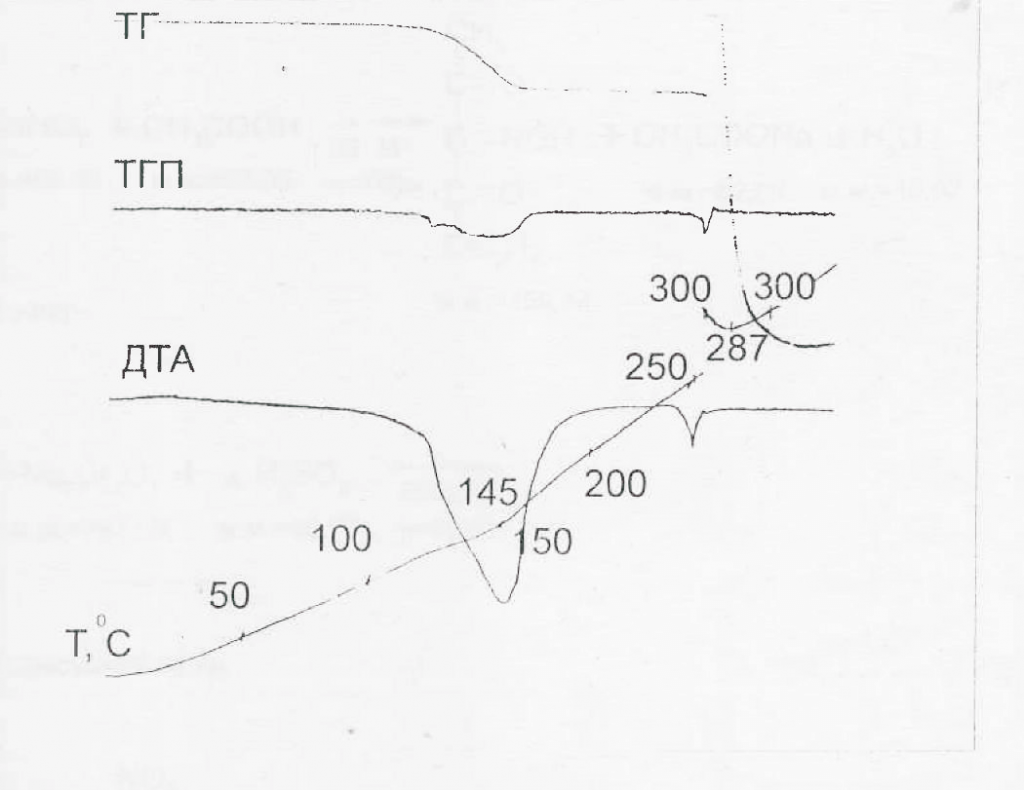
Рис.1 Дериватограмма субстанции Триазавирина
При температуре более 300°С происходит экзотермический распад препарата. При этом если субстанцию высушить при температуре выше температуры отщепления гидратной воды, то прямо на весах при её охлаждении наблюдается обратная сорбция воды в течение суток до 1-1.5 молекул на молекулу триазавирина. Вследствие такой особенности субстанции, что, несомненно, обусловлено наличием натрия в молекуле, было важно изучить причину высокой стабильности гидрата, в сравнении с высушенным образцом. Для этой цели был использован рентгеноструктурный анализ кристалла, полученного выпариванием водного раствора триазавирина в естественных условиях.
Химическая структура стандартного образца состава субстанции Триазавирин®, партия № 2, была доказана методом рентгено-структурного анализа. Структуры расшифрованы прямым методом и уточнены методом наименьших квадратов в анизотропном (изотропном для атомов водорода) приближении.
Кристаллы метилтиооксодигидротриазолотриазинида натрия (триазавирина), пригодные для рентгено-структурного анализа, были получены в результате медленного упаривания его водного раствора. Структура представлена на рис. 1.
Состав: C5H3N6NaO3S*2H2O.
Кристаллографические данные: триклинные кристаллы, пространственная группа Р-1;
Полученные результаты РСА показали, что оптимальным составом как для субстанции так и, соответственно, стандартного образца является дигидрат. Дальнейшие исследования были направлены на достижение оптимальной чистоты стандарта и подтверждение его методами ВЭЖХ по наличию одного пика в хроматограмме (рис. 2).
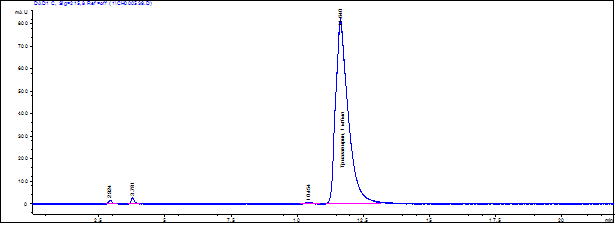
Рис. 2. Хроматотограмма стандартного образца триазавирина.
Аттестуемая характеристика - массовая доля метилтионитрооксодигидротриазоло-триазинида натрия (триазавирина®).
Установление значения аттестуемой характеристики проводили по РМГ 55-2003 методом высокоэффективной жидкостной хроматографии на хроматографе Agilent 1200 (CША), колонка Phenomenex Synergi max RP C 12, фирма Phenomenex (США), 4,6 ´ 250 мм, размер частиц 4 мкм.
В соответствии с РМГ 55-2003, аттестованное значение СО органического соединения высокой чистоты оценивали как 100 % минус массовая доля суммы примесей.
Примесями в субстанции «Триазавирин®» являются 3-метилтио-5-амино-1,2,4-триазол и другие примеси, что установлено методом высокоэффективной жидкостной хроматографии. Массовую долю суммы примесей, ввиду отсутствия соответствующих стандартных образцов для градуировки, оценивали методом внутренней нормализации хроматографических пиков. Измерения проводились в условиях повторяемости (3 параллельных измерения) и в условиях внутрилабораторной прецизионности (9 результатов измерений).
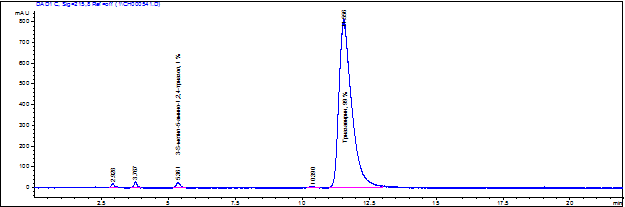
Рис.3. Хроматограмма смеси 99 % триазавирина и 1 % 3-Метилтио-5-амино-1,2,4-триазола
Среднее значение массовой доли суммы примесей в материале ГСО (партия № 1) составляет 0,4 %. Абсолютная погрешность аттестованного значения ГСО (партия № 1) составляет 0,8 %.
Таким образом, аттестованное значение СО (АСО) составляет:
АСО = 100,0 % – 0,4 %= 99,6 %
Погрешность аттестованного значения СО составляет:
∆ СО = √ (1,96* σ)2 + ε2,
∆ СО = √ (1,96* 0,4)2 + (0,008)2, ∆ СО = 0,8 %,
где ε – погрешность хроматографа Varian ProStar,
σ – СКО внутрилабораторной прецизионности, оценённое по статистическим данным
Выводы. Таким образом, на основе проведённых исследований был разработан, аттестован и зарегистрирован в Росстандарте стандартный образец состава субстанции Триазавирин ГСО 9875-2011. Поскольку за последние десять лет это первый пример регистрации стандартного образца субстанции, такой путь может быть рекомендован в качестве одного из вариантов создания стандартных образцов для анализа лекарственных субстанций.
Литература:
- Reference standards// European Pharmacopoeia, 01/2008:51200.
- Impurities in New Drug Substances. Q3a (r2). ICH Harmonised Tripartite Guideline. www.ich.org.
- Impurities in New Drug Products Q3b (r2). ICH Harmonised Tripartite Guideline. www.ich.org.
- Леонтьев Д. А. Фармацевтические стандартные образцы/ Аналитическая химия в создании, стандартизации и контроле качества лекарственных средств: в 3 томах на русском языке/ Под ред. Члена-кор. НАН Украины Георгиевского В. П. – Харьков: изд. НТМТ, – 2012. – Т. 3.
- ВФС 42-2893-97. Бромкамформа рацемическая. Стандартный образец.
- Государственная фармакопея СССР. ХI изд. Т.2, с.60-62.М.: Медицина, 1998.
- 61-ФЗ от 12 апреля 2010 г. «Об обращении лекарственных средств».
- 429-ФЗ от 22 декабря 2014 г. «О внесении изменений в Федеральный закон «Об обращении лекарственных средств».
- Стандартные образцы// Государственная фармакопея Украины/ Государственное предприятие «Украинский научный фармакопейный центр качества лекарственных средств» – Первое изд. – Дополнение 3. – Харьков, 2009. – с. 79–88.
- National laboratories for drug surveillance and control// Quality assurance of pharmaceuticals. A compendium guidelines and related matherials. Volume 1. WHO, Geneva. 1997. P 162–174.
- Стандартные образцы // Государственная Фармакопея 2. СССР: Вып 2. Общие методы анализа. Лекарственное растительное сырьё / МЗ СССР. – 11-е изд., доп. - М.: Медицина, 1989. – С. 60.
Александр Петров *, Евгений Сысуев **, Наталья Новикова,* Макарова И.С.***
*ГБОУ ВПО «Уральский государственный медицинский университет Минздрава России»;
**ФБУ «Государственный региональный центр стандартизации, метрологии и испытаний в Свердловской области»
***ООО «Уральский центр биофармацевтических технологий»

